感覺系統/感覺神經輔助器
視網膜植入
[編輯]二十世紀後期以來,用人工義眼還原盲人視力一直是全世界許多研究團隊和私人企業的目標。與耳蝸植入相似,它的關鍵概念是用電脈衝刺激視覺神經系統,繞過人類視網膜上受損或者退化的光感受器。這個章節我們將會描述視網膜植入的基本功能,以及目前研究開發出的不同方法。兩種最常用的視網膜植入方法是「上視網膜(epiretinal)」和「下視網膜(subretinal)」植入,對應義眼分別位於視網膜上部或下部。我們不會提及用任何非視網膜相關方法來恢復視力,例如BrainPort Vision System旨在從視覺輸入刺激舌頭,視神經周邊的袖帶電極,或初級視覺皮層中的刺激植入。
視網膜結構和功能
[編輯]下圖描繪了人類視網膜的神經結構概括。其中,我們可以區分三層細胞。第一層離晶狀體最遠,由光感受器(視杆細胞(rod)和視錐細胞(cone))組成,用於將入射光線轉換為電信號,然後進一步傳播到由雙極細胞組成的中間層。這些雙極細胞(bipolar cell)連接着光感受器以及不同細胞,例如水平細胞(horizontal cell)和無長突細胞(amacrine cell),傳遞電信號給視網膜神經節細胞(RGC)。關於雙極細胞功能的詳細描述,特別是將其分為開型(ON)和關型(OFF)雙極細胞,請參考視覺系統的章節。最上層由視網膜神經節細胞組成,收集來自水平細胞的電脈衝,並通過視神經傳遞到丘腦。從那裏,信號會傳播到初級視覺皮層。關於人類視網膜內的信號處理,有一些關鍵方面值得一提。首先,當雙極細胞以及水平和無長突細胞產生梯度電位,視網膜神經節細胞會產生動作電位。然後,視網膜中每種細胞的密度並不是均勻的。當中央凹區域中,視杆細胞和視錐細胞密度很高,而通過中間層連接着視網膜神經節細胞的光感受器很少時,更低密度的光感受器會在視網膜外圍區域,並且許多光感受器連接着單個視網膜神經節細胞。後者也對視網膜神經節細胞的感受野有着直接影響,它趨向於向視網膜外部區域快速增加,因為光感受器密度更低以及連接到同一個視網膜神經節細胞的光感受器數量增加。
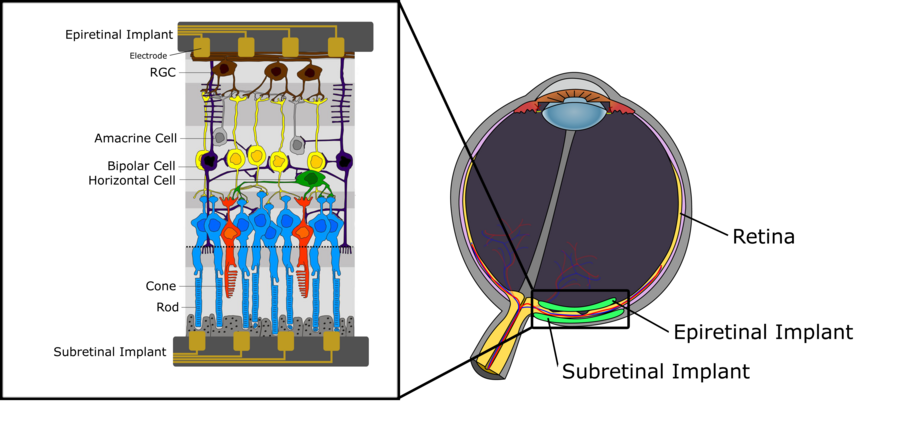
植入應用案例:視網膜退化疾病
[編輯]上面提到過,視網膜是一個位於眼睛後部的光感組織,由包括多種細胞類型的不同層組成。視網膜主要參與神經視覺處理,信號從光感受器產生並通過神經節細胞軸突到達大腦。當這個分層組織退化,就可能會發生永久性視覺損失[1]。這常常由視網膜退化疾病造成,例如老年性黃斑部退化(AMD)和視網膜色素變性(RP)是兩個逐步導致永久視覺障礙和喪失的最普遍情況。目前,這兩種視網膜疾病無法治癒,並且鑑於現代療法只能減緩疾病惡化,需要能恢復病人視力的策略。其中一種目前研究的方法是視網膜義體技術,用刺激有活力的視網膜組織來恢復視力。下文將會描述這一技術[2]。
老年性黃斑部退化(Age-Related Macular Degeneration, AMD)
[編輯]正如其名字所表示的,黃斑部退化是一種主要發作於老年個體的視網膜退化疾病。老年性黃斑部退化圍繞黃斑中的視錐光感受器逐步退化,導致視野中央視覺模糊。這可能會發展為視野中央視覺完全喪失,即盲點。儘管老年性黃斑部退化可能影響單眼或雙眼,它很少導致完全的失明,因為病人的外圍視覺仍然完好。老年性黃斑部退化有兩種主要類型:乾性和濕性。乾性老年性黃斑部退化占病例的大部分,表現為被稱作玻璃疣(drusen)的小型黃色沉積物,發生於視網膜色素上皮和脈絡膜之間的黃斑部。這種老年性黃斑部退化的進程一開始緩慢且症狀很少,僅在發生視網膜萎縮時加劇。濕性老年性黃斑部退化表現為脈絡膜新生血管,血管異常生長容易破裂,並導致血液和蛋白滲漏,疤痕最終導致視錐細胞永久損傷,以及因此喪失視力。濕性老年性黃斑部退化的發病進程和視力喪失比乾性快很多[3]。
視網膜色素變性(Retinitis Pigmentosa, RP)
[編輯]

視網膜色素變性是一種遺傳性眼部退化疾病,涉及杆狀感光細胞,且在年輕個體中發病較早。在這個疾病中,視杆細胞逐步退化並最終導致外圍視野和夜間視力喪失。這種視力喪失首先由外部發生,然後逐漸向內,造成病人的「隧道視野」。視力障礙對稱發生,雙眼在相似時間範圍內受到影響。跟老年性黃斑部退化不同,這種眼部疾病可以擴展到外圍,並通過錐狀感光細胞退化開始影響視野中央。這會使個人視力持續損失,最終導致完全失明,儘管這很少見。視網膜色素變性是基因遺傳,並且有多種基因變異可以導致視網膜色素變性的表現型,產生多種遺傳模式。但是,當遺傳模式為常染色體顯性,大部分病例與視紫紅質(rhodopsin)基因變異有關。這種變異破壞了視杆蛋白的功能,一種光傳導過程中的重要蛋白。視網膜色素變性目前無法治癒[2]。不過,2008年Shigeru Sato和他的同事發現一種細胞外基質狀視網膜蛋白Pikachurin,由於它涉及感光細胞和雙極細胞之間的作用,可以成為潛在疾病療法[4]。
用於視網膜刺激的微電極陣列(Microelectrode Array, MEA)
[編輯]
正如上文所述,黃斑部退化和視網膜色素變性造成的逐步視覺障礙是無法治癒的。但是,在兩種疾病中,儘管大量感光細胞損失,發病多年後仍然有顯著數量的內部視網膜神經存活。這提供了一個的機會來通過電極人工刺激剩餘仍然功能正常的視網膜細胞,為病人恢復視覺信息。微電極陣列用電極細胞外刺激視網膜,通過緊密排列來產生有陣列和生理鹽水環境的電化學界面。電流注入陣列-視網膜界面,並且最終驅動神經元細胞膜的去極化,產生動作電勢。這刺激可以是陰極或陽極。陰極刺激中,負電荷出現在細胞膜外,從而驅動細胞內的正電荷,導致去極化梯度在離電極最近處最強。陽極刺激中,超極化發生在最靠近電極的區域,而去極化發生在較遠處。所以,陰極刺激通常看起來更有效,因為它需要注入的電流低得多。刺激的相位不是僅有的因素以影響刺激效率。多種波形,例如單相和雙相,在視網膜神經元刺激的安全性上至關重要。比如,在猴子中,發現只有陽極的單相電流會破壞之前存活的細胞。因此,視網膜刺激的植入物將會運用電平衡的雙相波形。這種波形利用陰極刺激和陽極放電,因此能平衡細胞膜周圍的電荷。用這種刺激能力,視網膜義體可以植入於視網膜後面,即為下視網膜植入。這使得電極緊靠損傷的光感受器和功能正常的雙極細胞,也就是這裏真正的刺激目標。如果刺激電極穿透包含視網膜血液供給的脈絡膜,植入物有時就被稱為「脈絡膜上(suprachoroidal)」植入。或者植入物可能會被放在視網膜上,緊靠神經節細胞層,用於刺激視網膜神經節細胞,即上視網膜植入。兩種途徑現在正被幾個研究團隊探究,它們都有明顯的優點和缺點。在我們分別詳細地探討它們之前,先描述幾個在兩種情況下都要考慮的關鍵問題[2]。
挑戰
[編輯]電極技術挑戰
[編輯]一個很大的視網膜植入問題來自於人類視網膜中極高的神經細胞密度。人類視網膜中有大約1.25億光感受器(視杆細胞和視錐細胞)以及1500萬神經節細胞,對比人類耳蝸中只有大約15000毛細胞[5] [6]。在視力敏銳度最高的中央凹,多達150000視錐細胞處於一平方毫米內。雖然視網膜神經節細胞總數比光感受器少很多,它們在中央凹區域的密度跟視錐細胞的密度差不多,給在足夠高的解像度下用人造電極處理神經細胞造成一個巨大挑戰。幾乎所有目前的視網膜植入科學實驗,都用微電極陣列(micro-electrode array, MEA)刺激視網膜細胞。高解像度微電極陣列達到大約50微米的電極間距,產生每平方毫米400電極的密度。因此,以傳統電極技術,在中央凹區域內電極與光感受器或視網膜神經節細胞之間分別一對一關聯是不可能的。但是,兩種光感受器和視網膜神經節細胞的空間密度向視網膜外部區域快速下降,使得電極與外圍神經細胞之間的一對一刺激更可行[7]。另一個挑戰是在安全範圍內操作電極。施加高於0.1 mC/cm²的電極密度可能會損害神經組織[7]。一般來說,一個細胞越遠離刺激電極,刺激這個細胞所需的電流幅度越大。此外,刺激閾值越低,電極可能設計得越小,放在微電極陣列上的電極越緊湊,從而加強空間刺激解像度。刺激閾值被定義為,在至少50%的刺激脈衝中,引發神經反應所需的最小刺激強度。因此,一個設計視網膜植入的主要目標是用儘可能低的刺激電流,同時仍然保證對目標細胞的可靠刺激(即在視網膜神經節細胞的例子中產生動作電勢)。這可以通過兩種方式達到,要麼把電極放得儘量接近目標細胞區域,以對施加的電場脈衝產生最敏感的反應,要麼讓細胞突起(即樹突與/或軸突)長在電極上,使得即使細胞體在很遠的地方,也可以用很低的電流刺激細胞。此外,固定在視網膜的植入會自動跟隨眼球運動。儘管有一些明顯的好處,這也意味着任何植入的連接——用於調整參數,讀出數據,或者給刺激提供外部能源——需要一根隨着植入物運動的電纜。當我們大約每秒動眼睛三次,這電纜和涉及的連接暴露在嚴重的機械應力下。對於一個需要一生沒有外部干預仍然運作的設備,這對所包含的材料和技術提出了嚴峻挑戰。
生物相容性挑戰
[編輯]除了電問題,一個視網膜植入的關鍵挑戰是它會接觸生物組織。當一個外來物體,例如植入物,接觸生理物質,會觸發免疫反應。這反應一般是發炎或者隔離該物,經常會導致相關組織的疤痕。這是個問題,特別是對於視網膜植入,因為義體必須穿過組織插到合適的位置。如果所用的材料太尖銳或者沒有小心放置,對組織的傷害會進一步加劇免疫反應。另外,這些反應可能導致電信號隨時間丟失,因為免疫反應會隨時間「封鎖」刺激區域,使其難以持久植入。此外,一種上視網膜植入物Argus II,在病人體內3年後仍然運作,說明它已經能夠規避生物相容性問題。這個植入物由矽膠製成,一種有良好長期生物相容性的材料,但很僵硬,並不能輕易通過設備加工。其他材料,比如聚醯亞胺和金,已被研究於視網膜植入功能性和生物相容性。聚醯亞胺是一種有用於將來植入前景的聚合物,因為在短期研究中,用這種材料製成的植入物已經能在人眼上運作。由於它的高生物相容性,靈活性和低成本,這樣的材料很有優勢。微電極列陣需要不同基質以發揮最大的功能,而隨着技術進步製造出更複雜的微電極列陣,用於視網膜植入的合適材料優化也正在進行中[8] [9]。
下視網膜植入
[編輯]正如名字所述,下視網膜植入物是位於視網膜後面的視覺義體。因此,植入物離受損光感受器最近,旨在繞過視杆細胞和視錐細胞並在下一個視網膜神經層刺激雙極細胞。這個方法的主要優勢是,光感受器和雙極細胞之間需要被植入物模擬的視覺信號處理相對較少。也就是說,比如攝像機拍攝之類的原始視覺信息可以被直接地,或者僅需相對基本的信號處理,傳遞到微電極陣列來刺激雙極細胞,從信號處理的角度來說過程相當簡單。但是,這個方法也有一些嚴重的缺點。人類視網膜中光感受器的高空間解像度,使得微電極陣列需要足夠高的刺激解像度而因此電極間距較低,這給研發設計相應的微電極陣列帶來一個巨大挑戰。此外,當把電極放得靠近雙極細胞,神經層在z方向(x-y平面與視網膜曲率相切)上的堆疊增加了另一個困難。微電極陣列位於視網膜後面時,電極和目標細胞之間有一個明顯的空間間隙需要克服。如上文所述,提升的電極到目標細胞距離使微電極陣列在更高電流下運行,增加了電極尺寸,單個電極刺激範圍中的細胞數量,以及相鄰電極之間的分離空間。這些因素都使得刺激解像度下降,並使視網膜承受過高電荷密度造成組織損傷的風險。下面會說起,一個克服電極到目標細胞之間較大距離的方法,是讓細胞直接在電極上長出更長距離的突起。
2010年底,一個德國研究團隊與德國私人企業"Retina Implant AG"合作,發表了關於人類下視網膜植入項目的研究結果[10]。一個三乘三毫米的微光電二極管陣列(micro-photodiode array, MPDA)有1500像素,其中每個像素由單個感光光電二極管和一個電極組成,被植入到三位由黃斑部退化導致失明的病人視網膜後面。這些像素間距大約70微米,生成大致每平方毫米160個電極的空間解像度——或者正如論文作者指出的,每個電極的視錐角度為15弧分。需要注意的是,與用外部攝像頭來生成視覺輸入的植入物相反,微光電二極管陣列的每個像素本身包括一個感光光電二極管,能用眼球接收的光為它自己的相關電極自動產生電流。所以每個微光電二極管陣列像素對應一個感光細胞的全部功能。這有一個主要優勢:考慮到微光電二極管陣列是固定在人類視網膜後面的,它會隨着眼球運動自動拖動。又因為微光電二極管陣列本身接收視覺輸入來生成刺激電極所需的電流,頭部或眼球的運動被自然處理,無需人工處理。在其中一位病人中,微光電二極管陣列被直接置於黃斑部下面,對比其他兩位病人的微光電二極管陣列植入遠離視網膜中心,在實驗測試中有着卓越的效果。植入物置於病人黃斑部後面達成的結果非凡。他能識別字母(5-8厘米大小)和閱讀單詞,以及分辨不同方向的黑白圖形[10]。
微光電二極管陣列植入的實驗結果也引起了對另一種視覺現象的關注,揭示了微光電二極管陣列在用外部成像設備植入物時的又一優勢:後續刺激視網膜細胞會很快導致反應減弱,表明視網膜神經元在短時間內被重複刺激後將被抑制。這意味着,投射視覺輸入到固定在視網膜上或下部的微光電二極管陣列,會導致感知到的圖像迅速消失,即使電極的電刺激保持不變。這是由於固定在視網膜的電極一直刺激視網膜上的同一個細胞,使得細胞隨着時間對恆定的刺激越來越不敏感。不過,這過程是可逆的,一旦刺激源消失,細胞會重新獲得它們的初始敏感度。所以,完整的視覺系統是如何處理這種影響的?為什麼健康的人能鎖定一個物體而不會讓視覺隨時間淡化消失?在[11]其中提到,人眼其實在細小且難以察覺的眼睛運動中不斷調整,使得相同視覺刺激源隨時間投影在略微不同的視網膜點上,即使我們傾向於把目光聚焦固定在目標物體上。這成功規避了細胞反應衰弱的現象。正如微光電二極管陣列的情況下,當植入物同時成為光感受器和電極刺激器時,自然的細小眼睛調整可以輕易直接地用於處理這種影響。其他用外部視覺輸入(即攝像頭)的植入方法,在持續刺激下會遭遇投影圖像衰弱。因為外部運動可能與眼睛運動不一致,相機成像的快速人為抖動可能解決不了這一問題,所以視覺皮層可能將其簡單解釋為搖晃或模糊的場景,而不是想要的固定物體穩定長期投影。下視網膜植入的另一個優點是視網膜上的刺激區域與人體視野中刺激源的感知位置精準相關。視網膜神經節細胞在視網膜上的位置可能不是直接對應它們的個體感知野位置,與之不同,雙極細胞感知到的刺激正是視野中對應視網膜上雙極細胞幾何位置的那一點。下視網膜植入的一個明顯缺點是需要侵入性手術過程。
上視網膜植入
[編輯]上視網膜植入位於視網膜頂部,所以離視網膜神經節細胞(retina ganglion cell, RGC)最近。因此,上視網膜植入旨在直接刺激視網膜神經節細胞,繞過的不僅是受損光感受器,還有雙極細胞、水平細胞和無長突細胞的任何中間神經視覺處理。這有一些優點:首先,上視網膜植入的手術過程遠沒有下視網膜植入重要,因為義體不需要植入到眼睛後面。而且,視網膜神經節細胞比光感受器或者雙極細胞少得多,能用更大的電極間距(至少在視網膜外圍區域)進行更粗粒的刺激,或者用比實際視網膜神經節細胞密度更高的電極密度,來提高細胞刺激的靈活性和準確性。一項在獼猴身上進行的研究中,對外圍陽傘細胞(peripheral parasol cell)的上視網膜刺激研究提供了大量細節[7]。陽傘細胞是一種形成視網膜第二密集視覺通路的視網膜神經節細胞細胞。它們的主要目的是對視野中物體的運動進行編碼,因而感知運動。實驗在體外進行,把獼猴視網膜組織放在一個61電極的微電極陣列上(60微米電極間距)。25個陽傘細胞個體被確認且施以電刺激,同時進行特性分析,比如刺激閾值和最佳刺激位置。閾值電流定義為在目標細胞上能在50%的刺激脈衝(脈衝持續時間:50毫秒)中觸發峰位的最低電流,並以逐漸增加刺激強度直到記錄足夠的峰位反應來確定。請注意兩點:首先,陽傘細胞作為視網膜神經節細胞展現出動作電勢行為,與以分級電勢工作的雙極細胞相反。其次,微電極陣列上的電極同時用於刺激脈衝和記錄目標細胞的峰位反應。25個陽傘細胞位於61個微電極陣列的電極上,電極密度顯著高於陽傘細胞密度,在單個陽傘細胞的感受野中有效形成多電極情況。除了測量觸發有效細胞反應必需的刺激閾值,也確定了最佳刺激位置。最佳刺激位置指刺激電極對於目標細胞能達到最低刺激閾值的位置。令人驚訝的是,這並不如猜測的在細胞體上,而是在軸突路徑下大約13微米處。之後實驗表明了,隨着電極到細胞體的距離增加,刺激閾值電流中存在預期的二次增長。研究結果也展示出所有刺激閾值都遠低於安全限值(大約0.05mC/cm²,對比(低)安全限值為0.1mC/cm²),以及細胞對刺激脈衝的反應快速(平均0.2毫秒延遲)且準確(延遲方差小)。另外,電極密度高於陽傘細胞密度使得能通過刺激適當的電極來對單個細胞進行可靠追蹤,同時防止相鄰細胞也激發峰位。
其他技術方法概述
[編輯]這個部分,我們會簡要概述當前研究中的其他替代方法和技術。
納米管電極
[編輯]傳統微電極陣列包含氮化鈦或氧化銦錫製成的電極,使植入物面臨長期生物相容性的嚴重問題[12]。一種有前景的金屬電極替代物由碳納米管(carbon nanotube, CNT)組成,它結合了許多非常有利的特性。首先,它們是完全生物相容的,因其由純碳製成。其次,它們的穩定性使其很適合長期植入,這是對視覺義體來說很重要的特性。另外,良好的導電性讓它們能作為電極運作。最後,它們非常多孔的特質促成了極其大的接觸面,促進神經元長在碳納米管上,因而提高了神經元對電極的接觸並且降低了引起細胞反應所需的刺激電流。但是,碳納米管電極最近才出現,目前只有很少的科學結果可以得到。
無線植入方法
[編輯]視網膜植入的其中一個主要技術挑戰是關於連接微電極陣列與外部刺激源、電源供應和控制信號的電纜。電纜上的機械應力影響了它的長期穩定性和持久性,對使用的材料提出了一個很大的挑戰。無線技術可能是一種避免任何實際視網膜植入體和外部設備之間電纜的方法。射入眼睛的光能不足以激發神經反應。所以,為了讓無線植入物運作,必須給植入物提供額外的動力。斯坦福醫學院提出一種方法,用紅外液晶顯示器來投影護目鏡上攝相機捕捉的場景,反射紅外脈衝到置於視網膜上的晶片。晶片也是用光伏充電電池來提供轉換紅外線為足夠強的刺激脈衝所需的動力。與下視網膜方法相似,當眼睛自由運動時,它也能讓眼睛自然鎖定聚焦到場景中的物體,使得護目鏡上紅外影像的不同部分投影到視網膜晶片的不同區域。除了紅外線,感應線圈也可以用來從外部設備傳遞電力和數據信號到視網膜植入物。這個技術已經成功在EPIRET3視網膜植入中實現和測試[13]。但是,這些測試更偏向概念驗證,只有病人對用電極刺激產生視覺信號的感知能力得到測試。
定向神經生長
[編輯]一種能用極低電流且即便距離很遠也能進行非常精確神經刺激的方法,是讓神經元長出突起到電極上。通過在視網膜組織上塗抹正確的化學溶劑,可以促進神經生長。這可以用在微電極陣列表面塗抹一層層粘連蛋白(Laminin)達到。為了控制神經路徑,層粘連蛋白並沒有均勻地塗抹在微電極陣列表面,而是在狹窄路徑上構成與神經元應形成的連接對應的圖案。這個準確且模式化運用層粘連蛋白的過程,被稱為「微接觸印刷(microcontact printing)」。用這個方法達到的成功定向神經生長,使其能運用比傳統電極刺激明顯更低的刺激電流,同時仍然能有效觸發神經反應[14]。此外,刺激閾值不再遵循與電極-細胞體距離相關的二次增長,但即使距離很遠(>200微米)也仍在相同的低水平保持恆定。
用於表現視網膜功能的微電極陣列:基於CMOS的技術
[編輯]正如之前在視網膜植入的挑戰部分解釋的那樣,許多微電極陣列面臨電極間距大而數量少的問題,影響了他們的特異性和對神經網絡中神經元的指向性。這個因素限制了人們觀察神經群體的網絡動態和功能。具體來說,很多像軸突傳播速度和軸突信息處理之類的細胞細節會在較低密度的陣列中丟失。最近,研究人員已經利用互補氧化物半導體(complimentary-oxide-semiconductor, CMOS)技術來製造有高空間解像度的高密度微電極陣列,它能檢測這種細胞信息並且通過鉑黑沉積實現高信噪比。這種陣列在3.85 x 2.10 mm²感應陣列上可以有26400個微電極。以17.5 μm的間距,電極密度為每μm²3265個電極,伴隨着1024個讀取通道[15]。電極下有許多開關,各種電極配置可以用於評測晶片上的神經群體。擁有這樣敏感密集的電極晶片,單細胞鑑別,網絡水平分析,以及軸突信息都可以從神經細胞記錄到。這項技術為用於疾病建模和組織功能的電生理表現型「生物標誌」打開了大門,因為解剖的視網膜可以鍍在微電極陣列上並進行記錄[16]。
視網膜記錄
[編輯]光信號在視網膜內被解釋,這些信息儲存在神經節層的神經元中,即視網膜神經節細胞(retinal ganglion cell, RGC)。這些細胞之後通過的動作電勢傳遞這信息,動作電勢可以被微電極陣列記錄來理解視網膜電路、發育以及視覺場景編碼。這些體外實驗通常先從天然組織分離視網膜,以視網膜神經節細胞朝下的方向將組織鍍在陣列上,然後用光刺激記錄。之後數據用峰位分類分析,稍後會解釋這一方法。藥物阻斷劑和不同的光刺激可以被用於確定光感受器的反應和評定功能。此外,研究人員可以評估視網膜變異對視網膜神經節細胞峰值行為的影響,來確定電生理生物標記。在一項實驗中,研究人員將微電極陣列用於野生型小鼠和FRMD7基因敲除的小鼠。在受影響的個體中,FMRD7是和水平、依賴凝視的快速眼球運動有關的變異。微電極陣列記錄部分上的數據表明,視網膜中有對於水平方向選擇性細胞的反應缺失。野生型小鼠沒有對於水平或垂直方向選擇性細胞的反應缺失。這一發現揭示了在將來研究中,用微電極陣列技術來確定視網膜疾病電生理生物標記的的能力[17]。

峰位分類
[編輯]

其他視覺植入
[編輯]視神經刺激
[編輯]皮層植入
[編輯]
耳蝸植入
[編輯]
耳蝸植入部件
[編輯]
耳蝸植入信號處理
[編輯]波形策略
[編輯]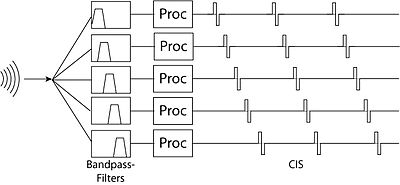
特徵提取策略
[編輯]當前發展
[編輯]
多麥克風
[編輯]集成耳蝸植入——助聽器
[編輯]精細結構
[編輯]
虛擬電極
[編輯]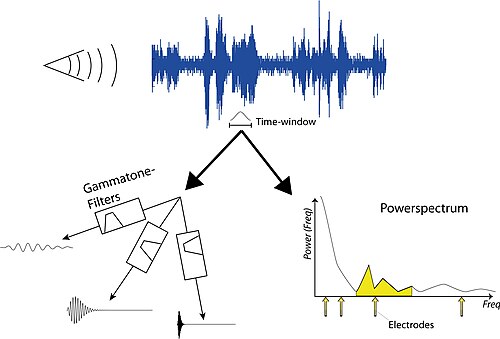
耳蝸植入模擬
[編輯]耳蝸植入和磁共振成像
[編輯]前庭植入
[編輯]介紹
[編輯]
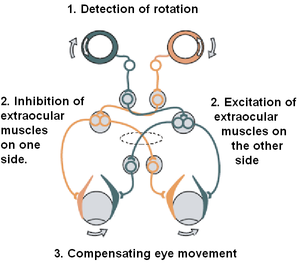
前庭義體進化(1963-2014)
[編輯]未來研究方向
[編輯]嗅覺植入
[編輯]

可行性研究
[編輯]未來方向
[編輯]氣味的電子測量
[編輯]電子鼻
[編輯]
傳感器陣列
[編輯]示例:導電聚合物傳感器的工作原理
[編輯]計算
[編輯]運用
[編輯]神經元的光遺傳刺激
[編輯]神經元的光刺激
[編輯]電刺激 vs 光刺激
[編輯]紅外線刺激
[編輯]光遺傳學
[編輯]
神經義體中的視神經刺激
[編輯]耳蝸植入
[編輯]前庭義體
[編輯]參考文獻
[編輯]- ↑ Larry Squire; 等. Fundamental Neuroscience 4th edition. 2012.
- ↑ 2.0 2.1 2.2 Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun. Retinal stimulation strategies to restore vision: Fundamentals and Systems. 2016.
- ↑ Jackson, G.R., Owsley, C., Curcio, C.A. Photoreceptor degeneration and dysfunction in aging and age-related maculopathy.. 2002.
- ↑ Shigeru Sato, Yoshihiro Omori; 等. Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation. 2008.
- ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann. Count and density of human retinal photoreceptors. Springer. 1992.
- ↑ Ashmore Jonathan. Cochlear Outer Hair Cell Motility. American Physiological Society. 2008.
- ↑ 7.0 7.1 7.2 Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky. High-Resolution Electrical Stimulation of Primate Retina for Epiretinal Implant Design. Society of Neuroscience. 2008.
- ↑ Jong-Mo Seo; 等. Biocompatibility of polyimide microelectrode array for retinal stimulation. 2004.
- ↑ Eui Tae Kim; 等. Feasibility of Microelectrode Array (MEA) Based on Silicone-Polyimide hybrid for retina prosthesis. 2009.
- ↑ 10.0 10.1 Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs et al.e Kim; 等. Subretinal electronic chips allow blind patients to read letters and combine them to words. 2010.
- ↑ Pritchard Roy. Stabilized Images on the Retina.
- ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor. Carbon nanotube electrodes for effective interfacing with retinal tissue. 2009.
- ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler. Stimulation with a Wireless Intraocular Epiretinal Implant Elicits Visual Percepts in Blind Humans. The Association for Research in Vision and Ophthalmology. 2011.
- ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent. A model retinal interface based on directed neuronal growth for single cell stimulation. Springer. 2006.
- ↑ Jan Muller; 等. High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels. 2015.
- ↑ Fiscella M; 等. Recording from defined populations of retinal ganglion cells using a high-density cmos-integrated microelectrode array with real-time switchable electrode selection. 2012.
- ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B and Hierlemann A. Screening Transgenic Mouse Models of Human Eye Diseases with CMOS High-Density Microelectrode Arrays. 2016.


